Teoria kinetyczno cząsteczkowa 
Wytłumaczenie natury zjawisk cieplnych nie było łatwym zadaniem.
Przez wiele lat zjawiska te wyjaśniano błędnie. Dopiero dzięki pracom
Boltzmanna i Maxwella udało się wreszcie zrozumieć dogłębnie na czym
polega przepływ ciepła, zmiany stanów skupienia ciał i wiele innych
powiązanych mechanizmów fizycznych. Do udowodnienia, że teorie
Boltzmanna i Maxwella są poprawne dołożył się także Albert
Einstein i polski fizyk Marian
Smoluchowski (dzięki badaniom nad tzw. ruchami
Browna).
Jeszcze w XIX wieku w celu tłumaczenia zjawisk cieplnych powszechnie
posługiwano się teorią cieplika. Zakładała ona, że ogrzewanie
i oziębianie ciał jest powiązane z przepływem specjalnego fluidu
zwanego cieplikiem. Co ciekawe - mimo, że teoria ta dzisiaj uważana jest
za błędną (bo nie dało się wykryć żadnej postaci owego fluidu, a
wszystko da się wytłumaczyć bardziej logicznie i konsekwentnie właśnie
dzięki teorii kinetycznej) , to w części zastosowań całkiem dobrze
przewidywała zjawiska cieplne. W oparciu o nią fizykom udało się
nawet dojść do (uznawanej przecież do dzisiaj) II zasady termodynamiki.
Jednak wobec bardzo wielu zjawisk, teoria cieplika okazała się bezsilna.
Nie pozwala ona na prawidłowe wytłumaczenie ruchów
Browna, dyfuzji i wielu innych zjawisk.
Ruch molekuł lepiej niż cieplik wyjaśnia zjawiska termodynamiki
Dziś wiemy, że nie ma fluidu zwanego cieplikiem. Wszystkie zjawiska
termodynamiki (i nie tylko tego działu) tłumaczy się w oparciu o teorię
kinetyczno - cząsteczkową. Jej wielką dodatkową zaletą jest to,
że w spójną całość łączy fizykę i chemię.
Teoria kinetyczno cząsteczkowa zjawiska cieplne tłumaczy za pomocą ruchu
cząsteczek. Przekazywanie energii na poziomie mikroskopowym (przepływ
ciepła) związane jest z
wzajemnymi zderzeniami tych cząsteczek. Im szybciej poruszają
się cząsteczki/ atomy danego ciała, tym większa jest temperatura
ciała. W temperaturze zera bezwzględnego cząsteczki nie poruszają się
wcale.
Temperatura jest wprost proporcjonalna do średniej energii
kinetycznej cząsteczek ciała.
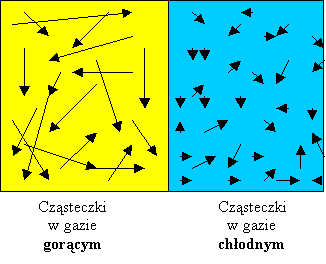 Gorące
ciała składają się cząsteczek energicznie poruszających się, chłodne
ciała mają cząsteczki bardziej „leniwe”. Oczywiście wraz
ze wzrostem prędkości rośnie także energia kinetyczna cząsteczek. Gorące
ciała składają się cząsteczek energicznie poruszających się, chłodne
ciała mają cząsteczki bardziej „leniwe”. Oczywiście wraz
ze wzrostem prędkości rośnie także energia kinetyczna cząsteczek.
Na rysunku obok widać, że strzałki symbolizujące prędkość są
znacznie dłuższe dla gazu określanego jako gorący. Ich prędkość
jest większa niż prędkość cząsteczek gazu chłodnego.
Ważnym pojęciem ściśle związanym z temperaturą jest energia
wewnętrzna. Główna różnica pomiędzy tymi pojęciami, jest związana
z faktem, że energia wewnętrzna rośnie wraz z ilością substancji, a
temperatura jest wyznaczana prawie w punkcie - w niewielkim obszarze
zawierającym materię. Temperatura nie zależy więc od ilości cząsteczek,
tylko od "średniego zachowania się" w danym obszarze.
|